Bài giảng Hóa học Lớp 10 - Tiết 51: Luyện tập
Bạn đang xem tài liệu "Bài giảng Hóa học Lớp 10 - Tiết 51: Luyện tập", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Bài giảng Hóa học Lớp 10 - Tiết 51: Luyện tập
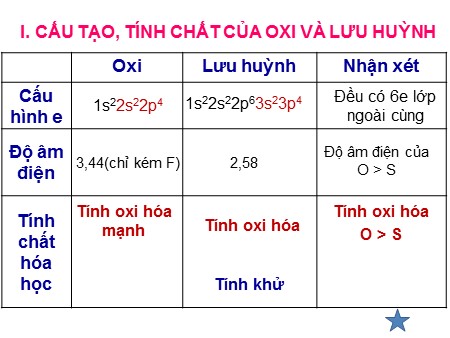
I. CẤU TẠO, TÍNH CHẤT CỦA OXI VÀ LƯU HUỲNH Oxi Lưu huỳnh Nhận xét Cấu Đều có 6e lớp 1s22s22p4 1s22s22p63s23p4 hình e ngoài cùng Độ âm Độ âm điện của 3,44(chỉ kém F) 2,58 điện O > S Tính oxi hóa Tính oxi hóa Tính mạnh Tính oxi hóa chất O > S hóa học Tính khử Tan trong nước tạo dd axit sunfuhiđric rất yếu Axit Tác dụng với dung dịch bazơ: yếu H2S + 1 NaOH → NaHS + H2O H2S + 2 NaOH → Na2S + 2H2O H2S Tính khử mạnh: -2 2 H2S + O2 → 2H2O + 2S S t° 2 H2S + 3O2 → 2H2O + 2SO2 + nước: SO3 + H2O → H2SO4 SO3 + dd bazơ: SO3 + 2NaOH → Na2SO4 + H2O là oxit axit + oxit bazơ: SO3 + CaO → CaSO4 Quỳ tím ẩm Hóa đỏ SO 3 BaSO ↓ trắng không tan trong dd Ba(OH)2 4 axit 7 Câu 2. Tính chất hóa học của H2S là A. Tính axit yếu và tính khử mạnh. B. Tính axit yếu và tính khử yếu. C. Tính axit mạnh và tính oxi hóa mạnh. D. Tính axit mạnh và tính oxi hóa yếu. Câu 4. Tính chất hóa học của H2S là A. Tính axit yếu và tính khử mạnh. B. Tính axit yếu và tính khử yếu. C. Tính axit mạnh và tính oxi hóa mạnh. D. Tính axit mạnh và tính oxi hóa yếu. Câu 6: Hấp thụ hoàn toàn 0,1 mol H2S vào dung dịch chứa 0,25 mol NaOH. Kết thúc phản ứng thu được muối gì? A. Na2S: 0,1 mol. B. NaHS: 0,1 mol. C. Na2S: 0,125 mol D. NaHS: 0,125 mol Câu 10: Cho S có cấu hình e lớp ngoài cùng: 3s23p4. Sau khi nhận thêm 2e thành anion S2- có cấu hình e lớp ngoài cùng là? A. 3s23p2 B. 3s23p3 C. 3s23p6 D. 3s23p5 Câu 11: Cho 2 phản ứng sau: 0 -2 0 +6 t0 S + Fe⎯ ⎯→ FeS (1) S + 3F2 →SF6 (2) Hãy chọn đáp án đúng về vai trò của S? A. (1): ch.oxh, (2): ch.khử B. (1): ch.khử, (2): ch.oxh C. (1),(2): đều là ch.oxh D. (1), (2): đều là ch.khử. 0 0 +4 -2 Câu 12: Phản ứng: S + O2 SO2 chứng tỏ tính oxh của S so với Oxi như thế nào? A. Mạnh hơn B. Yếu hơn C. Như nhau 15
File đính kèm:
 bai_giang_hoa_hoc_lop_10_tiet_51_luyen_tap.ppt
bai_giang_hoa_hoc_lop_10_tiet_51_luyen_tap.ppt