Đề cương ôn thi tốt nghiệp Hóa học 12 - Chương 8: Sơ lược về kim loại chuyển tiếp thứ nhất và phức nhất - Năm học 2024-2025
Bạn đang xem 20 trang mẫu của tài liệu "Đề cương ôn thi tốt nghiệp Hóa học 12 - Chương 8: Sơ lược về kim loại chuyển tiếp thứ nhất và phức nhất - Năm học 2024-2025", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề cương ôn thi tốt nghiệp Hóa học 12 - Chương 8: Sơ lược về kim loại chuyển tiếp thứ nhất và phức nhất - Năm học 2024-2025
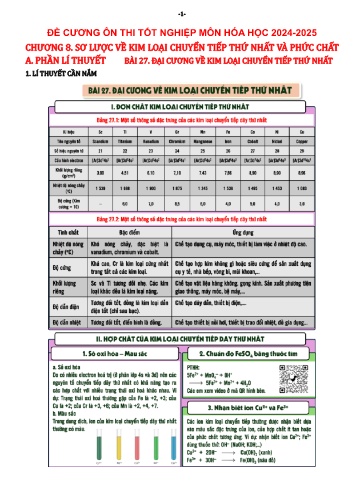
-1- ĐỀ CƯƠNG ÔN THI TỐT NGHIỆP MÔN HÓA HỌC 2024-2025 CHƯƠNG 8. SƠ LƯỢC VỀ KIM LOẠI CHUYỂN TIẾP THỨ NHẤT VÀ PHỨC CHẤT A. PHẦN LÍ THUYẾT BÀI 27. ĐẠI CƯƠNG VỀ KIM LOẠI CHUYỂN TIẾP THỨ NHẤT 1. LÍ THUYẾT CẦN NẮM -2- 2. BÀI TẬP VẬN DỤNG 2.1. Trắc nghiệm nhiều phương án lựa chọn Câu 1: (SBT – KNTT) Sự hình thành các nguyên tố chuyển tiếp dãy thứ nhất là do có sự sắp xếp lần lượt các electron vào phân lớp A. 3d. B. 4s. C. 4p. D. 3p. Câu 2: (OLTN) Kim loại chuyển tiếp dãy thứ nhất thuộc khối nguyên tố nào sau đây? A. Nguyên tố s. B. Nguyên tố p. C. Nguyên tố d. D. Nguyên tố f. Câu 3: (OLTN) Kim loại chuyển tiếp dãy thứ nhất có chứa phân lớp nào sau đây? A. 4d. B. 4f. C. 4p. D. 3d. Câu 4: (SBT – KNTT) Kim loại nào sau đây thuộc dãy kim loại chuyển tiếp thứ nhất? A. Ti. B. Al. C. Ba. D. Na. Câu 5: (OLTN) Kim loại chuyển tiếp dãy thứ nhất gồm A. 9 nguyên tố. B. 18 nguyên tố. C. 6 nguyên tố. D. 10 nguyên tố. Câu 6: (SBT – CTST) Các nguyên tố kim loại chuyển tiếp không cùng dãy thứ nhất là A. Sc, Ni, Ti. B. Fe, Mn, Co. C. Cr, Cu, V. D. Ni, Cu, Ag. Câu 7: Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố chuyển tiếp dãy thứ nhất được xếp ở A. chu kì 3. B. chu kì 4. C. chu kì 5. D. chu kì 3 và chu kì 4. Câu 8: Các electron hoá trị của nguyên tử nguyên tố kim loại chuyển tiếp dãy thứ nhất phân bố ở A. phân lớp 3d và phân lớp 4s. B. phân lớp 3d. C. lớp 4s. D. phân lớp 3p và phân lớp 3d. Câu 9: Ở trạng thái cơ bản, cấu hình electron của nguyên tử nào sau đây có phân lớp 3d bão hoà? A. Sc (Z = 21). B. Cu (Z = 29). C. Ni (Z = 28). D. Mn (Z = 25). Câu 10: (SBT – KNTT) Cấu hình electron của nguyên tử vanadium ở trạng thái cơ bản là [Ar]3d34s2. Trong bảng tuần hoàn, nguyên tố vanadium thuộc nhóm A. VB. B. IB. C. VIB. D. IIB. Câu 11: (SBT – KNTT) Từ cấu hình electron của nguyên tử Cu ở trạng thái cơ bản là [Ar]3d104s1, xác định được cấu hình electron của ion Cu2+ là A. [Ar]3d9. B. [Ar]3d84s1. C. [Ar]3d10. D. [Ar]3d8. Câu 12: (SBT – KNTT) Nguyên tử Cr có cấu hình electron ở trạng thái cơ bản là [Ar]3d54s1. Trong phản ứng hoá học, khi nguyên tử Cr nhường đi 3 electron để tạo thành ion Cr3+, số electron còn lại trên phân lớp 3d là A. 5. B. 4. C. 3. D. 2. Câu 13: (OLTN) Cấu hình electron nào sau đây là của kim loại chuyển tiếp dãy thứ nhất? A. [Ar]3d104s24p1. B. [Ar]3d64s2. C. [Ar]4s2. D. [Ar]3d104s24p6. Câu 14: (SBT – KNTT) Sắt là kim loại phổ biến thứ hai (sau nhôm) trên vỏ Trái Đất do nguyên tử sắt thuộc 56 loại nguyên tử bền. Số neutron có trong một nguyên tử sắt 26 Fe là A. 30. B. 26. C. 56. D. 28. Câu 15: (SBT – KNTT) Trong dãy nguyên tử Sc (Z = 21), Ti (Z = 22), V (Z = 23), Cr (Z = 24), bán kính nguyên tử biến đổi như thế nào? A. Tăng dần. B. Không đổi. C. Giảm dần. D. Không có quy luật. Câu 16: Đặc điểm chung cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất là -3- A. [Ne]3d1÷104s1÷2. B. [Ar]3d1÷104s1÷2. C. [Ar]3d1÷104s2. D. [Ar]3d104s1÷2. Câu 17: (SBT – CTST) Cấu hình electron của nguyên tử nguyên tố chromium (Z = 24) là A. [Ar]3d44s2. B. [Ar]4d55s1. C. [Ar]3d54s1. D. [Kr]3d54s1. Câu 18: (SBT – CTST) Cấu hình electron của nguyên tử nguyên tố copper (Z = 29) là A. [Ar]3d104s1. B. [Ar]3d94s2. C. [Ne]3d94s2. D. [Kr]3d104s1. Câu 19: Cấu hình electron của các ion Cr3+ (Z = 24), Co3+ (Z = 27), Fe3+ (Z = 26) lần lượt là A. [Ar]3d3, [Ar]3d6, [Ar]3d5. B. [Ar]3d3, [Ar]3d5, [Ar]3d6. C. [Ar]3d5, [Ar]3d6, [Ar]3d3. D. [Ar]3d3, [Ar]3d7, [Ar]3d5. Câu 20: (SBT – KNTT) Cấu hình electron của Cu2+ (Z = 29) là A. [Ar]3d94s2. B. [Ar]3d104s2. C. [Ar]3d84s1. D. [Ar]3d9. Câu 21: (OLTN) Cho các tính chất vật lí sau: (a) dẫn điện và dẫn nhiệt kém. (b) thường có khối lượng riêng lớn. (c) độ cứng cao. (d) nhiệt độ nóng chảy cao. Những tính chất vật lí thường gặp với các kim loại chuyển tiếp là A. (a), (b), (c). B. (a), (c), (d). C. (a), (b), (d). D. (b), (c), (d). Câu 22: (SBT – KNTT) Kim loại được mạ lên sắt để bảo vệ sắt và dùng để chế tạo thép không gỉ (dùng làm thìa, dao, dụng cụ y tế,...) là A. Na. B. Mg. C. Cr. D. Ca. Câu 23: (SBT – KNTT) Sắt được sử dụng để sản xuất nam châm trong các máy phát điện và nhiều thiết bị điện (loa, chuông, ti vi, máy tính, điện thoại,...) dựa trên tính chất nào sau đây? A. Tính dẫn điện. B. Tính dẫn nhiệt. C. Tính dẻo. D. Tính nhiễm từ. Câu 24: (SBT – KNTT) Đồng kim loại được sử dụng để chế tạo dây dẫn điện, thiết bị điện,.. dựa trên tính chất vật lí đặc trưng nào sau đây? A. Dẫn điện tốt. B. Tính dẻo. C. Dẫn nhiệt tốt. D. Ánh kim. Câu 25: Nguyên tố kim loại có trong hemoglobin làm nhiệm vụ vận chuyển oxygen, duy trì sự sống là A. sodium. B. magnesium. C. nhôm. D. sắt. Câu 26: (SBT – KNTT) Trong dãy kim loại chuyển tiếp thứ nhất, kim loại có độ cứng cao nhất là A. Ti. B. Fe. C. Cr. D. Cu. Câu 27: (SBT – KNTT) Trong dãy kim loại chuyển tiếp thứ nhất, hai kim loại nào sau đây đều là kim loại nhẹ (D < 5 g/cm3)? A. Cr, Mn. B. Fe, Co. C. Sc, Ti. D. Ni, Cu. Câu 28: (SBT – CTST) Dãy các đơn chất có nhiệt độ nóng chảy giảm dần từ trái sang phải là A. Fe, Cr, Co. B. V, Sc, Ti. C. Cr, Ni, Fe. D. Cu, Mn, Ni. Câu 29: (SBT – CTST) Ở khoảng 20 °C đến 25 °C, đơn chất có độ dẫn điện cao nhất là A. V. B. Cr. C. Co. D. Cu. Câu 30: Ở điều kiện thường, dãy các đơn chất kim loại có khối lượng riêng tăng dần từ trái sang phải là A. Sc, Ti, Co, Ni. B. V, Cr, Mn, Fe. C. Sc, Ti, Co, Cu. D. Sc, Ti, Ni, Cu. Câu 31: (SBT – KNTT) Trong dãy kim loại chuyển tiếp thứ nhất, kim loại có tính dẫn điện tốt nhất là A. Fe. B. Ti. C. Cu. D. Mn. -4- Câu 32: (SBT – KNTT) Nguyên tố nào sau đây được mệnh danh là “nguyên tố của màu sắc” do có khả năng thể hiện màu sắc phong phú? A. Sắt. B. Đồng. C. Nickel. D. Chromium. Câu 33: (SBT – KNTT) Dãy kim loại nào sau đây sắp xếp theo thứ tự tăng dần nhiệt độ nóng chảy? A. Na, Fe, Mg. B. Na, Mg, Fe. C. Fe, Mg, Na. D. Mg, Fe, Na. Câu 34: (SBT – KNTT) Khi so sánh kim loại Fe với Ca, nhận định nào sau đây không đúng? A. Có khối lượng riêng lớn hơn. B. Có độ cứng cao hơn. C. Có tính khử mạnh hơn. D. Có nhiệt độ nóng chảy cao hơn. Câu 35: (SBT – KNTT) Khi so sánh nguyên tử Ti với K, nhận định nào sau đây không đúng? A. Có bán kính lớn hơn. B. Có số electron hoá trị nhiều hơn. C. Có số electron độc thân nhiều hơn. D. Có độ âm điện lớn hơn. Câu 36: (SBT – CTST) Nhận xét nào sau đây là đúng? A. Sắt thuộc nhóm kim loại nặng và có nhiệt độ nóng chảy cao nhất trong dãy kim loại chuyển tiếp thứ nhất. B. Trong số các kim loại chuyển tiếp dãy thứ nhất, chromium có nhiệt độ nóng chảy cao nhất. C. Chromium có độ cứng cao nên được dùng mạ lên các thiết bị để chống mài mòn. D. Các đơn chất kim loại có khối lượng riêng lớn sẽ có độ cứng cao. Câu 37: (SBT – CD) Cho phát biểu “Nguyên tố kim loại chuyển tiếp dãy thứ nhất tạo nhiều hợp chất mà trong đó chúng có các số oxi hoá dương khác nhau, đó là do nguyên tố này có..(1).. và nguyên tử của chúng có..(2)...” Cụm từ cần điền vào (1) và (2) lần lượt là: A. độ âm điện bé, nhiều electron hoá trị. B. độ âm điện lớn, nhiều electron hoá trị. C. điện tích hạt nhân lớn, bán kính bé. D. bán kính bé, điện tích hạt nhân lớn. Câu 38: Nguyên tố nào sau đây không thể hiện xu hướng có nhiều số oxi hoá trong hợp chất? A. Cr. B. Mn. C. Fe. D. Mg. Câu 39: (SBT – KNTT) Nguyên tử manganese có số oxi hoá +4 trong hợp chất nào sau đây? A. KMnO4. B. K2MnO4. C. MnO2. D. MnSO4. Câu 40: (SBT – KNTT) Trong hợp chất K2Cr2O7, số oxi hoá của nguyên tử Cr là A. +6. B. +3. C. +2. D. 0. Câu 41: (SBT – CTST) Trạng thái oxi hoá phổ biến của Fe và Mn tương ứng là A. +2, +3 và +2, +4, +7. B. +2, +3 và +2, +4, +6. C. +2, +3 và +2, +6, +7. D. +2, +6 và +2, +4, +7. Câu 42: (OLTN) Ở trạng thái cơ bản, cấu hình electron của Mn (Z = 25) là [Ar]3d54s2. Số oxi hoá cao nhất của Mn trong các hợp chất là A. +5. B. +7. C. +2. D. +6. Câu 43: (OLTN) Cho các hợp chất của manganese: MnO, MnO(OH), Mn2O3 (MnO.MnO2), Mn3O4 (2MnO.MnO2), MnO(OH)2 và MnF3. Số hợp chất chứa nguyên tử Mn có số oxi hoá +3 là A. 2. B. 3. C. 4. D. 1. Câu 44: (OLTN) Trong các số oxi hoá của các kim loại chuyển tiếp dãy thứ nhất, trạng thái thường gặp nhất là +2. Điều này được giải thích là do đa số các kim loại chuyên tiếp dãy thứ nhất có độ âm điện không cao và A. dễ nhường đi 2 electron ở phân lớp 3d. B. dễ nhường đi 1 electron ở phân lớp 3d và 1 electron ở phân lớp 4s. C. có khả năng nhận thêm 2 electron vào phân lớp 3d. -5- D. có 2 electron lớp ngoài cùng. Câu 45: (SBT – KNTT) Dung dịch nào sau đây có màu vàng chanh? A. CuSO4. B. FeCl3. C. KMnO4. D. FeSO4. Câu 46: Ion nào sau đây không có electron trên phân lớp 3d và không có màu trong dung dịch nước? A. Fe3+. B. Cr3+. C. Ti3+. D. Sc3+. Câu 47: (OLTN) Dung dịch muối Fe2(SO4)3 có màu A. vàng nâu. B. xanh. C. tím. D. đỏ. Câu 48: (OLTN) Dung dịch muối chứa Cu2+(aq) có màu A. vàng. B. xanh. C. tím. D. đỏ. Câu 49: (SBT – KNTT) Trong dung dịch muối sulfate, ion kim loại nào sau đây có màu xanh? A. Mn2+. B. Fe3+. C. Ti3+. D. Cu2+. Câu 50: Ion nào sau đây vừa có khả năng thể hiện tính khử, vừa có khả năng thể hiện tính oxi hoá? 3+ 2– – 3+ A. Cr . B. CrO4 . C. AlO2 . D. Sc . Câu 51: Muối nào sau đây có khả năng làm mất màu thuốc tím trong môi trường sulfuric acid loãng? A. Na2SO4. B. FeSO4. C. MgSO4. D. Fe2(SO4)3. Câu 52: (SBT – KNTT) Nhỏ vài giọt dung dịch NaOH vào dung dịch FeCl3, thu được kết tủa có màu A. keo trắng. B. nâu đỏ. C. xanh lam. D. tím đen. o Câu 53: Kim loại nào sau đây thể hiện hai hoá trị khi tác dụng với dung dịch HCl và khí Cl2 (t )? A. Nhôm. B. Sắt. C. Đồng. D. Magnesium. Câu 54: (SBT – KNTT) Hợp chất iron(III) có khả năng thể hiện tính oxi hoá khi tác dụng với chất khử. Quá trình khử ion Fe3+ được biểu diễn là A. Fe3+ + le Fe2+. B. Fe2+ Fe3+ + le. C. Fe2+ + 2e Fe. D. Fe Fe2+ + 2e. Câu 55: (SBT – KNTT) Trong không khí ẩm, gang và thép bị ăn mòn điện hoá. Trong quá trình ăn mòn, sắt bị oxi hoá ở anode tạo thành ion Fe2+ theo quá trình A. Fe2+ + 2e Fe. B. Fe Fe2+ + 2e. C. Fe3+ + le Fe2+. D. Fe2+ Fe3+ + le. Câu 56: (SBT – KNTT) Muối nào sau đây vừa có khả năng thể hiện tính oxi hoá (trong môi trường acid), vừa có khả năng thể hiện tính khử (trong môi trường kiềm)? A. K2Cr2O7. B. Cr2(SO4)3. C. K2CrO4. D. Na2CrO4. Câu 57: (SBT – KNTT) Các hợp chất ứng với số oxi hoá cao nhất của Cr có tính oxi hoá mạnh. Giá trị thế 2– + 3+ điện cực chuẩn nào sau đây thuộc về cặp Cr2O7 , H /Cr ? A. –0,44 V. B. –2,93 V. C. 0 V. D. +1,36 V. Câu 58: (SBT – KNTT) Trong dung dịch K2Cr2O7 tồn tại cân bằng: 2– 2– + Cr2O7 (da cam) + H2O 2CrO4 (vàng) + 2H Cho vài giọt dung dịch chất X vào dung dịch K2Cr2O7 thì dung dịch chuyển dần từ màu da cam sang màu vàng. Chất phù hợp với X là A. K2SO4. B. H2SO4. C. KCl. D. KOH. Câu 59: (OLTN) Cho khoảng 2 mL dung dịch NaOH vào ống nghiệm chứa khoảng 1 mL dung dịch Fe2(SO4)3. Hiện tượng quan sát được là A. dung dịch chuyển sang màu xanh. B. xuất hiện kết tủa màu vàng. -6- C. xuất hiện kết tủa màu nâu đỏ. D. dung dịch chuyển sang màu nâu đỏ. Câu 60: (OLTN) Cho khoảng 2 mL dung dịch NaOH vào ống nghiệm chứa khoảng 1 mL dung dịch CuSO4. Hiện tượng quan sát được là A. dung dịch chuyển sang màu vàng. B. xuất hiện kết tủa màu xanh nhạt. C. xuất hiện kết tủa màu nâu đỏ. D. dung dịch chuyển sang màu nâu đỏ. Câu 61: (OLTN) Nước ngầm nhiễm sắt là nước chứa hàm lượng sắt hoà tan dưới dạng Fe2+ cao vượt quá mức cho phép (> 5 mg/L), gây ra hiện tượng nước có mùi tanh, vị chua, đục và sẫm màu. Một mẫu nước giếng khoan ô nhiễm sắt ở dạng Fe2+(aq) với nồng độ là 25 ppm (1 ppm = 1 mg/L). Nồng độ 2+ –1 mol của Fe trong nước giếng khoan là bao nhiêu? (Cho biết: MFe = 55,85 g.mol ) A. 4,48.10–4 mol/L. B. 2,24.10–4 mol/L. C. 5,60.10–4 mol/L. D. 2,50.10–4 mol/L. Câu 62: (OLTN) Có thể loại bỏ sắt trong nước ngầm bằng cách đưa nước ngầm lên các bể lắng, lọc và sục 2+ không khí vào. Khi đó Fe trong nước ngầm bị chuyển thành Fe(OH)3 và lắng xuống. Chất oxi hoá 2+ Fe thành Fe(OH)3 là – A. khí O2. B. khí N2. C. nước và khí O2. D. khí O2 và OH . Câu 63: (OLTN) Dung dịch chứa muối iron(II) trong môi trường acid khi để ngoài không khí bị chuyển từ màu xanh nhạt sang màu vàng nâu. Điều này được giải thích là do A. phân huỷ một phần tạo thành Fe và iron(III). B. oxygen trong không khí oxi hoá thành hợp chất có màu vàng nâu. C. oxygen trong không khí oxi hoá thành iron(III) oxide. D. oxygen trong không khí oxi hoá thành iron(III) hydroxide. Câu 64: (SBT – CTST) Dung dịch muối chromium(III) sulfate có lẫn copper(II) sulfate, sử dụng dung dịch nào sau đây có thể loại bỏ nguyên tố copper ra khỏi muối chromium(III) sulfate? A. Dung dịch ammonia. B. Dung dịch NaOH. C. Dung dịch barium chloride. D. Dung dịch soda. Câu 65: (SBT – CTST) Trong thí nghiệm xác định hàm lượng muối Fe(II) bằng dung dịch thuốc tím, nhận xét nào sau đây là không đúng? 2+ A. lon Fe là chất bị oxi hoá. B. H2SO4 là chất tạo môi trường phản ứng. – C. lon MnO4 là chất bị khử. D. Dung dịch muối Fe(II) có màu vàng nhạt. 2+ Câu 66: (OLTN) Phản ứng chuẩn độ Fe trong dung dịch acid bằng dung dịch KMnO4 được biểu diễn bởi phương trình ion rút gọn sau: – 2+ + 2+ 3+ MnO4 (aq) + 5Fe (aq) + 8H (aq) Mn (aq) + 5Fe (aq) + 4H2O(l). Chất oxi hoá trong phản ứng trên là 2+ 2+ – + A. Fe (aq). B. Mn (aq). C. MnO4 (aq). D. H (aq). 2+ – 2+ Câu 67: (OLTN) Trong phép chuẩn độ dung dịch Fe bằng MnO4 bình tam giác đựng dung dịch Fe thường được để trên 1 tờ giấy trắng. Mục đích của việc này là gì? A. Để phản ứng trong bình tam giác xảy ra nhanh hơn. B. Để quan sát sự thay đổi màu dung dịch trong bình tam giác được rõ hơn. C. Để nhận biết được sự thay đổi thể tích dung dịch burette được rõ hơn. D. Để nhận biết được sự xuất hiện màu của ion Fe3+ trong bình tam giác rõ hơn. 2+ Câu 68: Một học sinh tiến hành chuẩn độ dung dịch Fe bằng dung dịch KMnO4 theo hai cách như sau: 2+ Cách 1. Nhỏ từ từ dung dịch KMnO4 vào dung dịch chứa Fe trong môi trường acid cho đến khi xuất hiện màu hồng nhạt bền trong khoảng 30 giây. 2+ Cách 2. Nhỏ từ từ dung dịch chứa Fe trong môi trường acid vào dung dịch KMnO4 cho đến khi màu hồng của dung dịch KMnO4 biến mất. -7- Hãy cho biết cách tiến hành chuẩn độ nào là phù hợp? A. Cách 1. B. Cách 2. C. Cả hai cách. D. Không có cách nào. 2+ Câu 69: (OLTN) Chuẩn độ dung dịch Fe trong môi trường acid bằng dung dịch KMnO4. Kết quả sẽ không phù hợp nếu nồng độ dung dịch Fe2+ khá lớn (> 0,500 M). Điều này là do A. tiêu tốn một lượng dung dịch KMnO4 quá lớn. B. tại điểm tương đương, dung dịch có màu vàng đậm. C. Fe2+ dễ bị oxi hoá bởi oxygen của không khí. 3+ D. Fe sẽ bị oxi hoá tiếp bởi KMnO4. Câu 70: (OLTN) Chuẩn độ 10,00 mL dung dịch FeSO4 và H2SO4 loãng bằng dung dịch KMnO4 0,010 M. Kết quả thu được như sau: Lần thứ 1 2 3 Thể tích dung dịch KMnO4 (mL) 8,53 8,54 8,52 Nồng độ mol phù hợp nhất của FeSO4 trong dung dịch chuẩn độ là A. 4,263.10–2 M. B. 4,266.10–2 М. C. 4,264.10–2 М. D. 4,265.10–2 М. 2.2. Trắc nghiệm đúng – sai Câu 1: Theo IUPAC, nguyên tố chuyển tiếp là những nguyên tố có phân lớp d chưa được xếp (hoặc điền) đầy electron ở trạng thái nguyên tử hoặc ở trạng thái ion. Mỗi phát biểu dưới đây đúng hay sai? a. Calcium không phải là nguyên tố chuyển tiếp do không có phân lớp d trong cấu hình electron của nguyên tử. b. Nguyên tố có Z = 30 là nguyên tố chuyển tiếp. c. Nguyên tố có Z = 29 không phải là nguyên tố chuyển tiếp. d. Nguyên tố chuyển tiếp có tính kim loại nên còn được gọi là nguyên tố kim loại chuyển tiếp. Câu 2: (SBT – CD) Những đặc điểm nào sau đây là của nguyên tố kim loại chuyển tiếp dãy thứ nhất? a. Có các electron hoá trị phân bố cả trên phân lớp 3d và phân lớp 4s. b. Từ 21Sc đến 29Cu, số electron trong phân lớp d có xu hướng tăng dần (trừ trường hợp ngoại lệ). c. Thể hiện nhiều số oxi hoá dương hoặc âm trong các hợp chất. d. Tạo nên nhiều cation và anion có điện tích khác nhau. Câu 3: (OLTN) Mỗi phát biểu sau là đúng hay sai? a. Ở trạng thái cơ bản, lớp ngoài cùng của nguyên tử kim loại chuyển tiếp dãy thứ nhất có tối đa hai electron. b. Nguyên tố kim loại chuyển tiếp dãy thứ nhất đều có nhiều số oxi hoá trong các hợp chất. c. Phân lớp 3d trong nguyên tử các kim loại chuyển tiếp dãy thứ nhất đều chưa bão hoà. d. Các kim loại chuyển tiếp dãy thứ nhất đều là các nguyên tố nhóm B. Câu 4: (SBT – KNTT) Mỗi phát biểu nào sau đây là đúng hay sai? a. Các nguyên tố kim loại chuyển tiếp dãy thứ nhất thuộc khối d. b. Zn là nguyên tử kim loại chuyển tiếp dãy thứ nhất duy nhất có phân lớp 3d đã điền đầy electron. c. Nguyên tử của các kim loại chuyển tiếp dãy thứ nhất đều có lớp vỏ bên trong của khí hiếm Ar. d. Kim loại chuyển tiếp dãy thứ nhất thường tạo thành các hợp chất với nhiều số oxi hoá khác nhau. Câu 5: (SBT – KNTT) Mỗi phát biểu nào sau đây là đúng hay sai? a. Tất cả các nguyên tố thuộc nhóm B đều là nguyên tố chuyển tiếp dãy thứ nhất. b. Các nguyên tố chuyển tiếp dãy thứ nhất thường có nhiệt độ nóng chảy cao hơn các kim loại nhóm IA và IIA. c. Số oxi hoá của nguyên tử nguyên tố chromium trong hợp chất K2CrO4 và K2Cr2O7 bằng nhau. -8- d. Trạng thái oxi hoá thường gặp của Mn là +2, +4, +7. Câu 6: (SBT – KNTT) Ở điều kiện thường, tinh thể K và tinh thể Cr đều có cấu trúc lập phương tâm khối. Biết một số thông số của kim loại K và Cr được cho ở bảng sau: Tính chất K Cr Bán kính nguyên tử (pm) 227 128 Nhiệt độ nóng chảy (oC) 63,3 1 900 Khối lượng riêng (g/cm3) 0,862 7,19 Độ cứng (Kim cương = 10) 0,5 8,5 a. Tinh thể Cr có liên kết kim loại mạnh hơn tinh thể K. b. Trong cùng một đơn vị thể tích thì khối lượng kim loại trong tinh thể Cr và K bằng nhau. c. Nguyên tử Cr có bán kính nhỏ hơn nguyên tử K vì nguyên tử Cr có số lớp electron ít hơn. d. K là kim loại nhẹ và Cr là kim loại nặng. Câu 7: (SBT – KNTT) Ở trạng thái cơ bản, nguyên tử Cr có cấu hình electron là [Ar]3d54s1. a. Nguyên tố chromium thuộc chu kì 4, nhóm VIB trong bảng tuần hoàn. b. Chromium là kim loại nhẹ, có nhiệt độ nóng chảy thấp. c. Chromium là kim loại chuyển tiếp dãy thứ nhất. d. Nguyên tử chromiun có số oxi hoá cao nhất là +3 trong các hợp chất. Câu 8: Nguyên tử sắt có cấu hình electron là 1s22s22p63s23p63d64s2. Mỗi phát biểu sau là đúng hay sai? a. Sắt là kim loại chuyển tiếp dãy thứ nhất. b. Ion Fe2+ có 6 electron ở lớp ngoài cùng. c. Số oxi hoá cao nhất có thể có của sắt là +3. d. Ion Fe3+ có 5 electron độc thân ở lớp ngoài cùng. Câu 9: (SBT – CD) Từ kết quả phân tích phổ phát xạ nguyên tử của chromium (Z = 24) dẫn đến nhận định rằng nguyên tử này phải có 6 electron độc thân. Mỗi phát biểu dưới đây đúng hay sai? a. Nếu nguyên tử chromium có 6 electron độc thân thì nguyên tử này chứa 6 ô orbital nguyên tử mà trong mỗi ô này chỉ có 1 electron. b. Theo các quy ước về viết cấu hình electron thì cấu hình electron của nguyên tử chromium là [Ar]3d34s14p1. c. Cấu hình electron của nguyên tử là [Ar]3d54s1 sẽ phù hợp với nhận định từ phổ phát xạ của nguyên tử chromium. d. Cấu hình electron của nguyên tử phải luôn phù hợp với các quy ước về viết cấu hình electron. Câu 10: (SBT – CD) Mỗi phát biểu nào sau đây là đúng hay sai? a. Ở dạng đơn chất, sắt là kim loại nặng, có độ hoạt động hoá học mạnh. b. Sắt ít được sử dụng ở dạng nguyên chất. Sắt chủ yếu được sử dụng ở dạng hợp kim (thép thường, inox, ). c. Đinh đóng gỗ được làm bằng thép nhưng vẫn bị gỉ sét do ăn mòn điện hoá. d. Số oxi hoá của Fe trong các hợp chất FeO, Fe2O3 và FeO(OH).H2O lần lượt là +2, +3 và +3. Câu 11: (SBT – KNTT) Kim loại chuyển tiếp dãy thứ nhất có nhiều ứng dụng trong cuộc sống và sản xuất như: V được dùng để chế tạo thiết bị làm việc ở nhiệt độ cao; Cr được dùng để chế tạo mũi khoan; Ti được dùng để chế tạo vật liệu hàng không; Cu được dùng để chế tạo dây dẫn điện; a. V là kim loại có nhiệt độ nóng chảy cao. b. Cr là kim loại cứng nhất trong tất cả các kim loại. c. Ti là kim loại nặng. d. Cu là kim loại dẫn điện tốt nhất trong tất cả các kim loại. Câu 12: (CCG) Mỗi phát biểu nào sau đây là đúng hay sai? -9- a. Với nhiệt độ nóng chảy cao nên các kim loại chuyển tiếp dãy thứ nhất thường được dùng để chế tạo dụng cụ, máy móc, thiết bị làm việc ở nhiệt độ cao. b. Độ cứng của đồng rất cao nên được dùng làm vật liệu chế tạo hợp kim không gỉ hoặc siêu cứng để sản xuất dụng cụ y tế, nhà bếp, c. Cấu hình electron chung của các kim loại chuyển tiếp dãy thứ nhất có cấu hình electron [Ar]3d1– 104s1–2. d. Để phân biệt được một số ion kim loại chuyển tiếp có thể dựa vào màu sắc của chúng. Câu 13: (OLTN) Cho bảng số liệu sau của một số kim loại chuyển tiếp dãy thứ nhất như sau: Kim loại Cr Mn Fe Co Cấu hình electron nguyên tử [Ar]3d54s1 [Ar]3d54s2 [Ar]3d64s2 [Ar]3d74s2 Eo (V) M/M2 –0,912 –1,180 –0,440 –0,277 a. Tính khử của các kim loại giảm dần theo chiều tăng của số hiệu nguyên tử. b. Ở điều kiện chuẩn, kim loại manganese có thể khử được Fe2+(aq) thành kim loại. c. Ở trạng thái cơ bản, nguyên tử Cr có số electron độc thân lớn nhất trong các nguyên tử của các nguyên tố trên. + o d. Ở điều kiện chuẩn, ion H ( E 0,00 V ) oxi hoá được các kim loại Cr, Mn, Fe và Co (2H /H2 ) thành cation M2+. Câu 14: Mỗi phát biểu sau đây về nguyên tố kim loại chuyển tiếp dãy thứ nhất là đúng hay sai? a. Scandium và titanium nhẹ, bền nên được dùng để chế tạo hợp kim ứng dụng trong hàng không, vũ trụ. b. Nickel được dùng để chế tạo hợp kim trong sản xuất máy móc, thiết bị. c. Chromium có nhiệt độ nóng chảy cao nhất, được dùng để mạ lên các thiết bị chịu nhiệt. d. Sắt và manganese có khả năng tạo ra nhiều loại hợp kim với độ bền cơ học cao nên được dùng trong sản xuất các thiết bị quốc phòng, dân dụng. Câu 15: Để nhận biết sự có mặt của một số ion kim loại có thể tiến hành các thí nghiệm theo quy trình dưới đây: - Ống nghiệm (1): Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm (1) chứa khoảng 1 mL dung dịch CuSO4. - Ống nghiệm (2): Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm (2) chứa khoảng 1 mL dung dịch FeCl3. a. Xuất hiện kết tủa màu xanh trong ống nghiệm (1), kết tủa nâu đỏ trong ống nghiệm (2). b. Để kết tủa ống nghiệm (2) trong không khí một thời gian thì kết tủa chuyển sang màu vàng nâu. c. Nếu thay dung dịch NaOH bằng dung dịch NH3 thì hiện tượng trong cả hai ống nghiệm vẫn xảy ra tương tự. d. Dựa vào màu sắc của kết tủa có thể phân biệt được sự có mặt của ion Cu2+ và Fe3+ trong dung dịch. Câu 16: Thực hiện thí nghiệm theo các bước sau: - Bước 1: Cho một đinh sắt đã đánh thật sạch vào ống nghiệm (1). Rót vào ống nghiệm này 3 – 4 mL dung dịch HCl, đun nhẹ. Quan sát, chờ cho đến khi phản ứng gần kết thúc. - Bước 2: Đun sôi 4 – 5 mL dung dịch NaOH trong ống nghiệm (2) để đuổi hết oxygen hoà tan trong dung dịch. Rót nhanh dung dịch từ ống nghiệm (1) vào dung dịch NaOH ở ống nghiệm (2). Quan sát. - Bước 3: Lọc lấy kết tủa xuất hiện ở bước 2, đặt kết tủa vừa thu được trên mặt kính trong không khí. -10- a. Sau bước 1, trong ống nghiệm chỉ tạo thành FeCl3, dấu hiệu để nhận ra phản ứng gần kết thúc là bọt khí thoát ra chậm lại. b. Ở bước 2, kết tủa tạo thành màu trắng hơi xanh. c. Trong bước 3, sau một thời gian màu của chất rắn chuyển dần từ trắng xanh sang nâu đỏ. d. Dung dịch thu được ở bước 1 có thể hoà tan được kim loại đồng. Câu 17: (SBT – CD) Cho các thông tin sau: Cặp oxi hóa – khử Thế điện cực chuẩn (V) Fe3+/Fe2+ –0,77 2– + 3+ Cr2O7 + 14H /2Cr + 7H2O 1,33 – + 2+ MnO4 + 8H /Mn + 4H2O 1,53 Mỗi phát biểu dưới đây đúng hay sai? 2– a. Trong môi trường acid, anion Cr2O7 (từ sự phân li của muối potassium dichromate, K2Cr2O7) – có tính oxi hoá mạnh hơn anion MnO4 (từ sự phân li của muối KMnO4). 2+ 2+ 2– + b. Chuẩn độ được Fe trong dung dịch gồm Fe , SO4 và H bằng dung dịch chứa chất chuẩn là KMnO4. 2+ 2+ 2– + c. Không chuẩn độ được Fe trong dung dịch gồm Fe , SO4 và H bằng dung dịch chứa chất chuẩn là K2Cr2O7. d. Có diễn ra phản ứng oxi hoá – khử theo phương trình hoá học sau: 3+ 3+ 2+ 2– + 6Fe (aq) + 2Cr (aq) + 7H2O(l) 6Fe (aq) + Cr2O7 (aq) + 14H (aq) Câu 18: Khi sử dụng dung dịch potassium hydroxide để nhận biết các dung dịch riêng biệt copper(II) sulfate và iron(II) sulfate. Mỗi nhận định nào dưới đây là đúng hay sai? a. Đều tạo thành kết tủa màu xanh lam. b. Có kết tủa bị chuyển dần sang màu nâu đỏ. c. Có thể dùng dung dịch KMnO4 trong H2SO4 để nhận biết copper(II) sulfate và iron(II) sulfate. d. Nhỏ đến dư dung dịch potassium hydroxide vào dung dịch copper(II) sulfate sẽ thu được dung dịch trong suốt có màu xanh. Câu 19: (SBT – KNTT) Thí nghiệm xác định nồng độ muối Fe2+ bằng phương pháp chuẩn độ với dung dịch thuốc tím (KMnO4) xảy ra theo phương trình hoá học sau: 10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O a. Dung dịch thuốc tím được cho vào bình tam giác khi chuẩn độ. b. Dung dịch muối Fe2+ được cho vào burette khi chuẩn độ. c. Phản ứng xảy ra là phản ứng oxi hoá – khử. d. Khi kết thúc chuẩn độ, dung dịch trong bình tam giác có màu hồng tồn tại bền trong khoảng 20 giây là của lượng rất nhỏ KMnO4 dư. Câu 20: (SBT – KNTT) Tiến hành thí nghiệm xác định hàm lượng iron(II) sulfate bằng phương pháp chuẩn độ thuốc tím trong môi trường sulfuric acid loãng, dư. a. Thuốc tím phải cho vào burette, không được cho vào bình tam giác. b. Cần sử dụng chất chỉ thị để nhận biết điểm kết thúc chuẩn độ. c. Iron(II) sulfate là chất khử, thuốc tím là chất oxi hoá. d. Phải đun nóng dung dịch trong bình tam giác trước khi chuẩn độ. Câu 21: (SBT – CD) Hoà tan 0,422 g mẫu khoáng vật của sắt trong dung dịch sulfuric acid dư, sao cho tất cả lượng sắt có trong quặng đều chuyển thành Fe2+, thu được dung dịch A. Chuẩn độ Fe2+ trong dung dịch A bằng chất chuẩn là dung dịch thuốc tím KMnO4 0,040 M. Khi đã sử dụng 23,50 mL thì phản ứng vừa qua điểm tương đương. Mỗi phát biểu dưới đây là đúng hay sai? -11- a. Nếu chỉ có Fe2+ trong dung dịch A tác dụng được với thuốc tím thì việc chuẩn độ dung dịch A sẽ giúp xác định được lượng nguyên tố sắt trong mẫu khoáng vật. Từ đó tính được % (theo khối lượng) của nguyên tố sắt có trong mẫu khoáng vật là 60,26%. b. Trong quá trình chuẩn độ trên, cần nhỏ từ từ dung dịch thuốc tím từ burette vào bình tam giác chứa dung dịch A. c. Cần thêm chất chỉ thị phù hợp vào bình tam giác chứa dung dịch A để xác định được thời điểm kết thúc quá trình chuẩn độ. d. Cần lặp lại thí nghiệm chuẩn độ 2 lần để bảo đảm tính chính xác của kết quả. 2+ Câu 22: (OLTN) Chuẩn độ V1 mL dung dịch chứa muối Fe nồng độ C1 (M) và dung dịch H2SO4 loãng, đựng trong bình tam giác bằng dung dịch KMnO4 nồng độ C2 (M) để ở burette và để ở vạch 0. Khi vạch thể tích dung dịch KMnO4 trên burette là V2 mL thì trong bình tam giác xuất hiện màu hồng bền trong khoảng 20 giây. a. Phản ứng chuẩn độ là: – 2+ + 2+ 3+ MnO4 (aq) + 5Fe (aq) + 8H (aq) Mn (aq) + 5Fe (aq) + 4H2O(l). b. Khi màu hồng trong bình tam giác bền trong khoảng 20 giây thì có thể coi như phản ứng vừa đủ. c. Mối quan hệ giữa V1, C1, V2 và C2 được biểu diễn qua biểu thức: V1.C1 = 5V2.C2. d. Có thể thực hiện phép chuẩn độ trên bằng cách đựng dung dịch KMnO4 ở bình tam giác và dung dịch chứa Fe2+ trong môi trường acid ở burette cho kết quả tương tự. Câu 23: Phản ứng giữa potassium permanganate (KMnO4) và iron(II) sulfate (FeSO4) được acid hóa là phản ứng oxy hóa khử diễn ra như sau: + 2+ – 2+ 3+ 8H (aq) + 5Fe (aq) + MnO4 (aq) Mn (aq) + 5Fe (aq) + 4H2O(l) Một dung dịch KMnO4 0,20 M được đặt trong buret để chuẩn độ 50,00 mL dung dịch FeSO4 có nồng độ chưa biết trong một bình tam giác. Bảng sau đây mô tả màu sắc của các ion khác nhau trong dung dịch: + 2+ – 2+ 3+ + 2– Ion H Fe MnO4 Mn Fe K SO4 Không Xanh Không Vàng Không Không Màu sắc Tím đậm màu nhạt màu nâu màu màu Kết thúc chuẩn độ thì thể tích dung dịch KMnO4 0,20 M đã sử dụng là 12,5 mL. a. Nồng độ dung dịch FeSO4 trong bình tam giác là 0,25 М. b. Tại điểm tương đương, dung dịch chỉ chứa các ion Fe3+, Mn2+. c. Màu sắc của dung dịch trong bình tam giác sẽ chuyển từ màu xanh nhạt sang màu tím khi đạt đến điểm tương đương. d. Một lỗi kĩ thuật xảy ra là thể tích dung dịch FeSO4 được thêm vào bình là 55,00 mL thay vì 50,00 mL thì kết quả tính nồng độ FeSO4 sẽ nhỏ hơn so với thực tế. Câu 24: Hàm lượng sắt trong các mẫu quặng có thể biến đổi đa dạng, tùy vào vị trí tìm thấy. Một nhóm học sinh tìm thấy một quặng sắt có thành phần chính là Fe2O3 và quan tâm đến việc có bao nhiêu sắt trong loại quặng đó. Nhóm học sinh tiến hành các bước phân tích như sau: - Bước 1: Cân 7,50 gam quặng, cho vào trong cốc rồi rót dung dịch nitric acid đậm đặc dư vào. - Bước 2: Thêm một lượng phù hợp dung dịch sodium hydroxide vào dung dịch trên, thấy có kết tủa X màu nâu đỏ xuất hiện. - Bước 3: Thu lấy toàn bộ kết tủa bằng phễu lọc. Nung nóng kết tủa ở 900 °C cho đến khi khối lượng không thay đổi thì thu được 3,19 gam chất rắn Y. Giả sử rằng các tạp chất trong mẫu quặng đã bị loại bỏ hoàn toàn trước khi kết tủa. a. Kết tủa X màu nâu đỏ là Fe(OH)3. b. Dung dịch NaOH có tác dụng trung hòa acid dư và kết tủa ion Fe2+. -12- c. Có thể thay dung dịch NaOH bằng dung dịch KOH ở bước 2. d. Hàm lượng sắt theo khối lượng trong mẫu quặng ban đầu là 35,0%. 2+ Câu 25: Để xác định hàm lượng Fe trong một lọ muối Mohr (có công thức (NH4)2SO4.FeSO4.6H2O) người ta tiến hành thí nghiệm như sau: - Cân 5,00 gam muối rồi hoà tan vào nước, thêm tiếp 5 mL dung dịch H2SO4 20% rồi cho nước cất vào để được 100 mL dung dịch (kí hiệu là dung dịch X). - Lấy 10 mL dung dịch X đem chuẩn độ bằng dung dịch chuẩn KMnO4 0,02 M thì thấy hết 10 mL. a. Phương trình phản ứng chuẩn độ là: 6FeSO4 + 2KMnO4 + 4H2SO4 3Fe2(SO4)3 + K2SO4 + 2MnO2 + 4H2O. b. Thời điểm kết thúc chuẩn độ là lúc dung dịch xuất hiện màu hồng và tồn tại khoảng 20 giây. c. Khi để trong không khí lâu ngày thì hàm lượng FeSO4 trong muối Mohr sẽ thay đổi. d. Hàm lượng Fe2+ trong mẫu muối Mohr đem phân tích ở trên là 1,12%. 2.3. Trắc nghiệm trả lời ngắn Câu 1: (SBT – CD) Số electron hoá trị của nguyên tử sắt (Z = 26) là bao nhiêu? Câu 2: Số electron hoá trị của nguyên tử chromium (Z = 24) là bao nhiêu? Câu 3: (SBT – CD) Số electron độc thân của nguyên tử cobalt (Z = 27) là bao nhiêu? Câu 4: (OLTN) Cấu hình electron của sắt (Fe) là 1s22s22p63s23p63d64s2. Xác định số electron độc thân trong ion Fe2+. Câu 5: Titanium (Ti) là kim loại chuyển tiếp dãy thứ nhất và có cấu hình electron là 1s22s22p63s23p6 3d24s2. Đa số ứng dụng của titanium liên quan đến vật liệu sản xuất động cơ và khung máy bay. Trong các hợp chất, số oxi hoá cao nhất của Ti là +a. Xác định giá trị của a. Câu 6: (OLTN) Chromium (Cr) có độ bền cơ học và hoá học rất cao, do đó người ta thường thêm Cr vào thép để chế tạo các loại thép không gỉ (inox). Biết số hiệu nguyên tử của chromium là 24. Xác định số electron độc thân trong ion Cr3+. Câu 7: (SBT – KNTT) Ở 20 °C, độ tan của CuSO4.5H2O trong nước là 32,0 g trong 100 g nước. Ở nhiệt độ này, dung dịch CuSO4 bão hoà có nồng độ là a%. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến phần mười). Câu 8: Chromium có tính cứng cao. Nickel (Ni) có đặc tính cơ học là cứng, dễ dát mỏng, dễ uốn, dễ kéo sợi và đặc tính hoá học là trơ với không khí nên khi thêm vào inox để việc gia công dễ dàng hơn. Inox 18/10 có thành phần hoá học gồm 18% chromimum, 10% nickel và tối đa 0,08% carbon (C). Xác định khối lượng iron (tính theo kg) tối đa trong 1,00 tấn inox 18/10. Câu 9: (CCG) X là quặng hematite chứa 60% Fe2O3. Y là quặng magnetite chứa 69,6% Fe3O4. Trộn mX tấn quặng X với mY tấn quặng Y, thu được quặng Z. Từ 1 tấn quặng Z có thể điều chế được 0,5 tấn gang chứa 4% carbon. Tính tỉ lệ mX/mY là bao nhiêu? Câu 10: (HTHH) Ở 20 °C, độ tan của KMnO4 trong nước là 6,34 g trong 100 g nước. Ở nhiệt độ này, dung dịch KMnO4 bão hoà có nồng độ là a%. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến phần trăm). Câu 11: Chuẩn độ 5,00 mL dung dịch FeSO4 nồng độ a M trong H2SO4 cần vừa đủ 4,50 mL dung dịch KMnO4 0,02 M. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến phần trăm). Câu 12: (SBT – KNTT) Tiến hành thí nghiệm theo các bước sau: Bước 1: Dùng pipette hút chính xác 5,00 mL dung dịch FeSO4 nồng độ a mol/L cho vào bình định mức loại 50 mL. Thêm tiếp nước cất và định mức đến vạch, thu được 50 mL dung dịch Y. Bước 2: Chuẩn độ 10,00 mL dung dịch Y trong môi trường H2SO4 loãng cần vừa đủ 8,80 mL dung dịch KMnO4 0,02 M. -13- Giá trị của a là bao nhiêu? (Làm tròn kết quả đến phần trăm). Câu 13: (Đề MH – 2024) Khi bảo quản trong phòng thí nghiệm, muối Mohr (FeSO4.(NH4)2SO4.6H2O) hút ẩm và bị oxi hóa một phần bởi O2 trong không khí thành hỗn hợp X. Để xác định phần trăm khối lượng muối Mohr trong X, tiến hành hòa tan hoàn toàn 2,656 gam X trong nước rồi pha thành 100,0 mL dung dịch Y. Chuẩn độ 10,00 mL dung dịch Y (trong môi trường sulfuric acid loãng, dư) bằng dung dịch KMnO4 nồng độ 0,012 M đến khi xuất hiện màu hồng nhạt thì dừng. Lặp lại thí nghiệm chuẩn độ thêm 2 lần nữa. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 9,72 mL. Phần trăm khối lượng của muối Mohr trong X là a%. Tính giá trị của a (làm tròn đến hàng phần mười). Câu 14: (HTHH) Tiến hành thí nghiệm theo các bước sau: Bước 1: Hoà tan hoàn toàn 4,00 g một mẫu muối FeSO4.7H2O (đã bị oxi hoá một phần bởi oxygen không khí) trong dung dịch H2SO4 loãng, định mức thành 100 mL dung dịch X. Bước 2: Chuẩn độ 5,00 mL dung dịch X bằng dung dịch KMnO4 0,02 M trong môi trường sulfuric acid cần dùng 4,00 mL thuốc tím. Hàm lượng FeSO4.7H2O trong mẫu ban đầu là a%. Giá trị của a là bao nhiêu? Câu 15: Hoà tan hết 2 g mẫu chất rắn có thành phần chính là muối (NH4)2SO4.FeSO4.6H2O (muối Mohr) vào 20 2+ mL dung dịch H2SO4 1 M, thêm nước thu được 100,0 mL dung dịch X. Để phản ứng vừa đủ với Fe trong 10,0 mL dung dịch X cần dùng 5,0 mL dung dịch KMnO4 0,02 M (Các chất và ion khác trong dung dịch không phản ứng với KMnO4). Xác định % khối lượng (NH4)2SO4.FeSO4.6H2O trong mẫu muối trên. (Làm tròn kết quả đến hàng phần mười). Câu 16: (OLTN) Sự gia tăng hàm lượng nitrate trong nước là một trong những nguyên nhân của hiện tượng phú dưỡng. Một trong những quy trình xác định hàm lượng nitrate trong nước được thực hiện như sau: Thí nghiệm 1. Lấy 10,0 mL dung dịch muối Mohr [(NH4)2SO4.FeSO4.6H2O], thêm H2SO4 1 M vào và chuẩn độ bằng dung dịch KMnO4. Thí nghiệm 2. Lấy 10,0 mL dung dịch muối Mohr cho vào 100 mL nước chứa ion nitrate, sau đó thêm NaOH(s) vào để đạt khoảng 28%, khi đó muối Mohr khử nitrate thành ammonia theo các phản ứng: – – NO3 (aq) + 2Fe(OH)2 + H2O NO2 + 2Fe(OH)3; (1) – – NO2 (aq) + 6Fe(OH)2 + 5H2O NH3 + 6Fe(OH)3 + OH ; (2) Sau khi các phản ứng (1) và (2) hoàn toàn, lọc bỏ kết tủa, acid hoá dung dịch bằng dung dịch H2SO4 2+ 1 M và chuẩn độ lượng Fe dư bằng dung dịch KMnO4 (Các chất và ion khác trong dung dịch không phản ứng với KMnO4). Hãy cho biết mỗi mmol KMnO4 chênh lệch giữa thí nghiệm 1 với thí – nghiệm 2 sẽ tương ứng với bao nhiêu mg NO3 trong nước. (Làm tròn kết quả đến hàng phần mười). 2+ Câu 17: (OLTN) Trong quá trình bảo quản, một phần Fe trong muối FeSO4.7H2O bị oxygen oxi hoá thành 3+ Fe (chất X). Lấy 1,12 g X đem hoà vào 10,0 mL dung dịch H2SO4 1,00 M thu được dung dịch Y. Chia Y thành hai phần bằng nhau: 2+ Phần 1. Thêm nước vào thu được 100 mL dung dịch Y1. Lượng Fe trong 10,0 mL dung dịch Y1 phản ứng vừa đủ với 3,8 mL dung dịch KMnO4 0,01 М. Phần 2. Cho qua cột chứa Zn(Hg) để khử hoàn toàn ion Fe3+ thành ion Fe2+, thêm tiếp 5 mL dung 2+ dịch H2SO4 1 M và nước vào dung dịch sau khi qua cột đến 100,0 mL (dung dịch Y2). Lượng Fe trong 10,00 mL Y2 phản ứng vừa đủ với 4,0 mL dung dịch KMnO4 0,01 M. Xác định % iron(II) đã bị oxygen trong không khí oxi hoá thành iron(III). (Làm tròn kết quả đến hàng phần mười). -14- Câu 18: (CCG) Hòa tan hoàn toàn 10 gam hỗn hợp muối khan FeSO4 và Fe2(SO4)3 thu được dung dịch A. Cho A phản ứng vừa đủ với 1,58 gam KMnO4 trong môi trường acid H2SO4. Thành phần phần trăm theo khối lượng của FeSO4 trong hỗn hợp ban đầu là bao nhiêu? Câu 19: (CCG) Trong quy trình bảo quản, một mẫu muối FeSO4.7H2O (có khối lượng m gam) bị oxi hoá bởi không khí tạo thành hỗn hợp X chứa các hợp chất của Fe(II) và Fe(III). Hòa tan toàn bộ X trong dung dịch loãng chứa 0,05 mol H2SO4, thu được 100 mL dung dịch Y. Tiến hành hai thí nghiệm với Y: Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 25 mL dung dịch Y thu được 4,66 gam kết tủa. Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 25 mL dung dịch Y thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,1 M vào Z đến khi phản ứng vừa đủ thì hết 13,5 mL. Thành phần phần trăm số mol Fe(II) đã bị oxi hoá là bao nhiêu? Câu 20: (SBT – KNTT) Theo QCVN 01-1:2018/BYT, hàm lượng sắt tối đa cho phép trong nước sinh hoạt là 0,30 mg/L. Một mẫu nước có hàm lượng sắt cao gấp 28 lần ngưỡng cho phép, giả thiết sắt trong mẫu nước tồn tại ở dạng Fe2(SO4)3 và FeSO4 với tỉ lệ mol tương ứng là 1: 8. Quá trình tách loại sắt trong 10 m3 mẫu nước trên được thực hiện bằng cách sử dụng m gam vôi tôi (vừa đủ) để tăng pH, sau đó sục không khí: Fe2(SO4)3 + Ca(OH)2 Fe(OH)3 + CaSO4 (1) FeSO4 + Ca(OH)2 + O2 + H2O Fe(OH)3 + CaSO4 (2) Giả thiết vôi tôi chỉ chứa Ca(OH)2. Giá trị của m là bao nhiêu? (Làm tròn kết quả đến hàng đơn vị). Câu 21: (SBT – KNTT) Các nghiên cứu được thực hiện với một muối carbonate của kim loại M (hoá trị II) như sau. Nghiên cứu 1: Tiến hành phân tích hàm lượng các nguyên tố, xác định M chiếm 48,28% khối lượng muối. Nghiên cứu 2: Nung nóng muối carbonate tới phản ứng hoàn toàn trong các khí quyển khác nhau: Thí nghiệm 1 2 3 Khí quyển N2 O2 HCl Phần trăm chênh lệch giữa khối lượng mẫu chất rắn sau khi nung so với muối ban đầu ở thí nghiệm 2 là a%. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến hàng đơn vị). Câu 22: (SBT – KNTT) Iron(II) sulfate thường được bảo quản ở dạng muối Mohr màu xanh nhạt có công thức FeSO4.(NH4)2SO4.nH2O. Thực hiện các thí nghiệm sau: Thí nghiệm 1: Cân 1,96 g muối Mohr rồi hoà tan vào nước, sau đó định mức trong bình 50 mL. Chuẩn độ 5,00 mL dung dịch vừa pha cần dùng 5,00 mL dung dịch KMnO4 0,02 M trong môi trường H2SO4 loãng. Xác định công thức phân tử muối Mohr. Thí nghiệm 2: Làm lạnh 100 g dung dịch muối Mohr bão hoà ở 30 °C đến nhiệt độ ổn định ở 0 °C, thu được m gam muối Mohr kết tinh. Cho độ tan của muối Mohr trong nước ở các nhiệt độ như sau: Nhiệt độ (oC) 0 10 20 30 Độ tan (g/100 g nước) 17,2 31,0 36,4 45,0 Giá trị của m là bao nhiêu? (Làm tròn kết quả đến phần mười). Câu 23: (SBT – KNTT) Khi làm lạnh dung dịch FeCl3 thu được tinh thể FeCl3.6H2O. Cho độ tan của FeCl3.6H2O trong nước ở một số nhiệt độ như sau: Nhiệt độ (oC) 0 20 30 Độ tan (g/100 g nước) 74,4 91,8 106,8 -15- Dung dịch bão hoà của FeCl3 ở 0 °C có nồng độ phần trăm là bao nhiêu? (Làm tròn kết quả đến phần mười). Câu 24: (SBT – KNTT) Thuốc tím dễ bị phân huỷ khi bảo quản nên trước khi sử dụng thuốc tím pha sẵn cần xác định lại nồng độ bằng cách chuẩn độ với dung dịch H2C2O4. Tiến hành thí nghiệm theo các bước sau: Bước 1: Cân chính xác lượng oxalic acid ngậm nước (H2C2O4.2H2O, M = 126,07) để pha chế được 100 mL dung dịch H2C2O4 có nồng độ chuẩn 0,05 M. Bước 2: Dùng pipette hút 5,00 mL dung dịch H2C2O4 vừa pha chế cho vào bình tam giác. Chuyển –2 dung dịch KMnO4 nồng độ a.10 mol/L vào burette rồi tiến hành chuẩn độ đến khi dung dịch trong bình tam giác có màu hồng nhạt bền khoảng 10 giây thì vừa hết 5,10 mL. Giá trị của a là bao nhiêu? -16- BÀI 28. SƠ LƯỢC VỀ PHỨC CHẤT 1. LÍ THUYẾT CẦN NẮM 2. BÀI TẬP VẬN DỤNG 2.1. Trắc nghiệm nhiều phương án lựa chọn Câu 1: (SBT – CD) Cho phát biểu sau: “Phức chất đơn giản thường có một..(1).. liên kết với các phối tử bao quanh. Liên kết giữa nguyên tử trung tâm và phối từ trong phức chất là liên kết..(2)..”. Cụm từ cần điền vào (1) và (2) lần lượt là A. cation kim loại, ion. B. nguyên tử kim loại, cho – nhận. C. nguyên tử trung tâm, cho – nhận. D. phối tử, ion. 2– Câu 2: (SBT – KNTT) Phối tử trong phức chất [PtCl4] và [Fe(CO)5] lần lượt là A. Cl và C. B. Pt và Fe. C. Cl và CO. D. Cl và CO. 2– Câu 3: (SBT – KNTT) Số lượng phối tử có trong mỗi phức chất [PtCl4] , [Fe(CO)5] lần lượt là A. 4 và 5. B. 5 và 6. C. 2 và 5. D. 1 và 2. 2– Câu 4: (SBT – KNTT) Nguyên tử trung tâm của phức chất [PtCl4] và [Fe(CO)5] lần lượt là A. Pt4+ và Fe2+. B. Pt2+ và Fe2+. C. Cl và CO. D. Pt2+ và Fe. 2– Câu 5: (SBT – KNTT) Điện tích của phức chất [PtCl4] và [Fe(CO)5] lần lượt là A. +2 và +5. B. +2 và 0. C. –1 và 0. D. –2 và 0. Câu 6: (OLTN) Trong phân tử phức chất [Ag(NH3)2]OH, nhóm NH3 được gọi là -17- A. phối tử. C. chất oxi hoá. B. acid. D. nguyên tử trung tâm. Câu 7: (OLTN) Trong phân tử phức chất K3[Fe(CN)6], sắt (iron) được gọi là A. phối tử. B. base. C. chất khử. D. nguyên tử trung tâm. Câu 8: (OLTN) Số oxi hoá của nguyên tử trung tâm trong phức chất [Co(NH3)4(OH2)2]SO4 là A. +3. B. +6. C. +2. D. +4. 2– Câu 9: (OLTN) Số oxi hoá của nguyên tử trung tâm platinum trong phức chất [PtCl6] là A. +2. B. +3. C. +4. D. +6. 3+ 3– Câu 10: Điện tích của nguyên tử trung tâm trong phức chất [Co(NH3)6] và [FeF6] lần lượt là A. +3 và +3. B. +3 và +2. C. +6 và –6. D. +3 và –3. Câu 11: (SBT – KNTT) Số lượng phối tử có trong phức chất [PtCl4(NH3)2] là A. 6. B. 2. C. 4. D. 7. Câu 12: Với phối tử Cl–, tất cả các ion nào sau đây sẽ là nguyên tử trung tâm trong phức chất tứ diện? A. Cu2+, Ni2+, Mn2+. B. Fe3+, Cr3+, Co³+. C. Cr3+, Co3+, Sc3+. D. Ni2+, Cu2+, Zn2+. Câu 13: (OLTN) Khi cho kim loại sodium tác dụng với phức chất [Mn2(CO)10] thu được hợp chất phức Na[Mn(CO)5] với phối tử carbonyl (CO). Số oxi hoá của Mn trong phức chất Na[Mn(CO)5] là A. +2. B. +1. C. –1. D. 0. Câu 14: Theo thuyết Liên kết hoá trị, để trở thành phối tử trong phức chất thì phân tử hoặc anion cần có A. các orbital trống. B. ít nhất 4 orbital trống. C. cặp electron hoá trị riêng. D. ít nhất hai cặp electron hoá trị riêng. Câu 15: Trong phức chất, giữa phối tử và nguyên tử trung tâm có loại liên kết nào sau đây? A. Ion. B. Hydrogen. C. Cho – nhận. D. Kim loại. Câu 16: (OTTN) Phần tử có thể trở thành phối tử trong phức chất là A. anion hoặc phân tử trung hoà có cặp electron hoá trị riêng. B. anion có kích thước lớn. C. phân tử trung hoà có hoặc không có cặp electron hoá trị riêng. D. cation kim loại chuyển tiếp có các orbital trống. Câu 17: (OTTN) Phần tử có thể trở thành nguyên tử trung tâm trong phức chất khi chúng sử dụng các orbital trống để nhận cặp electron hoá trị riêng từ phối tử. Các phần tử đó là A. tất cả các cation kim loại. B. nguyên tử hoặc cation của một số kim loại. C. các nguyên tử nguyên tố chuyển tiếp dãy thứ nhất. D. các cation kim loại của nguyên tố chuyển tiếp dãy thứ nhất. Câu 18: Theo thuyết Liên kết hoá trị, tương tác giữa phối tử và nguyên tử trung tâm trong phức chất là A. liên kết cộng hoá trị theo kiểu cho – nhận. B. liên kết ion. C. tương tác van der Waals. D. liên kết hydrogen. 2+ Câu 19: (OLTN) Trong phức chất [Fe(OH2)6] , mỗi phân tử H2O sử dụng bao nhiêu electron để tạo liên kết phối trí với AO trống của ion Fe2+? A. 2. B. 1. C. 4. D. 6. Câu 20: (OLTN) Trong phân tử phức chất [Cu(OH2)2(NH3)4]SO4, nguyên tử trung tâm copper tạo liên kết cho – nhận với những phối tử nào? -18- 2– A. Chỉ có H2O. B. Chỉ có NH3. C. Chỉ có SO4 . D. Cả NH3 và H2O. 3– Câu 21: (SBT – KNTT) Dạng hình học có thể có của phức chất [FeF6] là A. tứ diện. B. bát diện. C. vuông phẳng. D. tứ diện hoặc vuông phẳng. Câu 22: (SBT – KNTT) Công thức tổng quát của phức chất (với nguyên tử trung tâm M và phối tử L) có dạng tứ diện và bát diện lần lượt là A. [ML2] và [ML4]. B. [ML4] và [ML6]. C. [ML6] và [ML2]. D. [ML6] và [ML4]. Câu 23: Chọn đáp án đúng nhất về dạng hình học có thể có của phức chất có công thức tổng quát [ML4]. A. Tứ diện. B. Bát diện. C. Vuông phẳng. D. Tứ diện hoặc vuông phẳng. 2+ Câu 24: (SBT – KNTT) Phức chất [Cu(H2O)6] có dạng hình học là A. vuông phẳng. B. tứ diện. C. bát diện. D. đường thẳng. Câu 25: Phức chất của Cr(0) có dạng hình học bát diện chỉ chứa phối tử CO có công thức hoá học là 2+ 2+ A. [Cr(CO)4]. B. [Cr(CO)6]. C. [Cr(CO)4] . D. [Cr(CO)6] . Câu 26: (SBT – CTST) Phức chất nào sau đây có dạng hình học không phải là tứ diện? 2– 2– 2– – A. [CuCl4] . B. [CoCl4] . C. [PdCl4] . D. [FeCl4] . Câu 27: (SBT – CTST) Phức chất có dạng hình học không phải tứ diện là 2– 2– – – A. [CoBr4] . B. [PtBr4] . C. [Al(OH)4] . D. [FeCl4] . 2– Câu 28: (SBT – KNTT) Chọn đáp án đúng nhất sau về liên kết trong phức chất [PtCl4] . A. Là liên kết cộng hoá trị được hình thành do sự cho cặp electron chưa liên kết từ phối tử Cl– vào nguyên tử trung tâm Pt2+. B. Là liên kết cộng hoá trị được hình thành do sự cho cặp electron chưa liên kết từ nguyên tử trung tâm Pt2+ vào phối tử Cl–. C. Là liên kết tĩnh điện giữa nguyên tử trung tâm Pt2+ và phối tử Cl–. D. Là liên kết cộng hoá trị được hình thành do sự ghép đôi cặp electron của phối tử Cl– và nguyên tử trung tâm Pt2+. Câu 29: (SBT – CTST) Nhận xét nào sau đây là không đúng? A. Nguyên tử trung tâm chỉ có thể là cation kim loại. B. Thành phần của phức chất có nguyên tử trung tâm và phối tử. C. Phối tử còn cặp electron chưa liên kết, có khả năng cho nguyên tử trung tâm. D. Liên kết giữa phối tử và nguyên tử trung tâm là liên kết cho – nhận. Câu 30: (SBT – CD) Phát biểu nào sau đây không đúng về phức chất? A. Phức chất đơn giản thường có một nguyên tử trung tâm liên kết với các phối tử bao quanh. B. Phức chất có thể mang điện tích hoặc không mang điện tích. C. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết ion. 2– D. K2[PtCl4] hoặc anion [PtCl4] đều được xếp vào loại phức chất. Câu 31: (SBT – CTST) Nhận định nào sau đây là đúng? A. Phức chất chỉ có dạng hình học là bát diện. B. Phức chất luôn chứa cầu ngoại. C. Phức chất có các dạng hình học khác nhau. D. Một phức chất có thể tồn tại ở các dạng hình học khác nhau. -19- 2+ Câu 32: (OLTN) Thực nghiệm cho biết phức chất [Co(en)3] (trong đó en là kí hiệu của ethylenediamine, H2N–CH2–CH2–NH2) có 6 liên kết cho – nhận giữa nguyên tử trung tâm với các phối tử. Mỗi phối tử en đã liên kết với nguyên tử trung tâm qua A. hai nguyên tử carbon. B. hai nguyên tử nitrogen. C. một nguyên tử carbon và một nguyên tử nitrogen. D. một nguyên tử nitrogen và một nguyên tử hydrogen. Câu 33: (OLTN) Cho carbon monoxide liên tục đi qua nickel (Ni) nung nóng ở 80 °C, thu được phức chất [Ni(CO)4] ở thể khí. Tiếp tục dẫn [Ni(CO)4] qua khu vực có nhiệt độ khoảng 200 °C, phức chất [Ni(CO)4] phân huỷ thu được nickel tinh khiết. Quá trình này được ứng dụng để tinh chế nickel. Số oxi hoá của nickel trong phức chất [Ni(CO)4] là A. +2. B. +1. C. –1. D. 0. Câu 34: Phức chất đơn nhân với nguyên tử trung tâm platinum (Pt) tạo được 4 liên kết cho nhận với phối tử ethylenediamine (H2N–CH2–CH2–NH2) và chloro; trong đó ethylenediamine liên kết với nguyên tử trung tâm qua hai nguyên tử nitrogen. Công thức phân tử của phức chất là A. PtCl2(C2H8N2). B. PtCl2(C2H8N2)2. C. PtCl(C2H8N2)3. D. PtCl(C2H8N2)2. Câu 35: Khi cho dung dịch KCN đến dư vào dung dịch iron(II) sulfate thu được phức chất bát diện; trong đó nguyên tử trung tâm iron tạo 6 liên kết sigma với 6 nguyên tử carbon trong phối tử cyano (CN– ). Công thức của phức chất là 3– 4– 2+ 2+ A. [Fe(CN)6] . B. [Fe(CN)6] . C. [Fe(CN)4] . D. [Fe(CN)6] . Câu 36: Nhỏ dung dịch KCN đặc đến dư vào dung dịch AgNO3 thu được phức chất X. Trong phức chất X, nguyên tử trung tâm bạc tạo 2 liên kết σ với nguyên tử carbon trong phối tử cyano (CN–). Công thức của phức chất là + 3– – A. [Ag(CN)2] . B. [Ag(CN)4] . C. [Ag(CN)2] . D. [Ag(CN)2]. Câu 37: (OLTN) Phức chất [Mn2(CO)10] có cấu tạo như hình dưới: Số nguyên tử trung tâm trong phức chất là A. 2. B. 3. C. 1. D. 4. Câu 38: Phân tử phức chất cis-dichloro(ethylendiammine)platinium(II) có cấu tạo như hình dưới: Có bao nhiêu loại phối tử có trong phân tử phức chất đó? A. 1. B. 2. C. 3. D. 4. Câu 39: Phức chất pentacarbonyliron(0) (hoặc iron pentacarbonyl) có công thức cấu tạo như hình dưới: Số liên kết cho – nhận mà nguyên tử trung tâm iron tạo được với các phối tử là A. 5. B. 6. C. 4. D. 3. -20- 3+ Câu 40: (OLTN) Phức chất [Fe(OH2)6] có cấu tạo như hình dưới: Số liên kết cho – nhận mà nguyên tử trung tâm iron tạo được với các phối tử OH2 là A. 5. C. 4. B. 3. D. 6. 2.2. Trắc nghiệm đúng – sai Câu 1: (SBT – CD) Mỗi phát biểu nào sau đây là đúng hay sai về nguyên tử trung tâm trong phức chất? a. Nguyên tử trung tâm trong phức chất là cation kim loại hoặc nguyên tử kim loại đã nhận cặp electron hoá trị riêng của phân tử hoặc anion. 3+ 3+ b. Cation tạo nguyên tử trung tâm trong phức chất [Co(OH2)] là Co . c. Nguyên tử trung tâm trong phức chất là các nguyên tố kim loại chuyển tiếp. 2+ d. Nguyên tử trung tâm trong phức chất [Ni(CO)4] được hình thành từ quá trình cation Ni sử dụng các orbital trống để nhận các cặp electron hoá trị của các phân tử CO. Câu 2: (SBT – CD) Theo thuyết Liên kết hoá trị, mỗi phát biểu nào sau đây là đúng hay sai? a. Phối tử là các phân tử hoặc anion đã cho một hoặc một số cặp electron hoá trị riêng. – – b. Các phần tử gồm NH3, N2, H2, OH , Cl đều có thể trở thành phối tử trong phức chất. 2+ c. Có phối tử là anion và phối tử là phân tử trong phức chất [Cu(NH3)4(OH2)2] . d. Khi tham gia quá trình tạo phức chất, phân tử ethylenediamine (H2N-CH2-CH2-NH2) sử dụng hai cặp electron hoá trị riêng để tạo 2 liên kết cho – nhận. Câu 3: (OLTN) Mỗi phát biểu sau đây là đúng hay sai? a. Phức chất có thể mang điện tích hoặc không mang điện tích. b. Các phức chất mà nguyên tử trung tâm tạo được 4 liên kết sigma với các phối tử luôn có dạng hình học tứ diện. c. Giống như phân tử ammonia (NH3), phân tử methylamine (CH3NH2) cũng có thể đóng vai trò phối tử do có cặp electron chưa liên kết. d. Các anion HO–, Cl–, I– đều có thể tạo phức vì đều có cặp electron hoá trị riêng. Câu 4: (OLTN) Mỗi phát biểu sau là đúng hay sai? a. Phức chất có thể mang điện tích hoặc không mang điện tích. b. Phức chất mà nguyên tử trung tâm tạo 4 liên kết σ với các phối tử luôn có dạng hình học là tứ diện. c. Phức chất mà nguyên tử trung tâm tạo 6 liên kết σ với các phối tử luôn có dạng hình học là bát diện. 3– d. Trong phức chất bát diện [Cr(C2O4)3] , mỗi phối tử oxalato tạo được hai liên kết sigma với nguyên tử trung tâm. Câu 5: (OLTN) Mỗi phát biểu sau là đúng hay sai? a. Liên kết giữa nguyên tử trung tâm với phối tử trong phức chất là liên kết cho – nhận. b. Để hình thành phức chất, các cation kim loại hoặc nguyên tử kim loại dùng các AO hoá trị trống để nhận cặp electron từ các phối tử. c. Mỗi phối tử chỉ liên kết với nguyên tử trung tâm bằng một liên kết sigma (σ). d. Trong phức chất, mỗi nguyên tử trung tâm chỉ liên kết với một loại phối tử. Câu 6: (OLTN) Mỗi phát biểu sau là đúng hay sai? a. Các kim loại chuyển tiếp đều chỉ tạo phức chất bát diện. b. Các cation kim loại chuyển tiếp tạo phức bền hơn so với các kim loại nhóm A.
File đính kèm:
 de_cuong_on_thi_tot_nghiep_hoa_hoc_12_chuong_8_so_luoc_ve_ki.pdf
de_cuong_on_thi_tot_nghiep_hoa_hoc_12_chuong_8_so_luoc_ve_ki.pdf