Đề thi thử môn Hóa học - Kỳ thi thử THPT Quốc gia lần 2 - Năm học 2018-2019 - Trường THPT Nguyễn Trung Thiên - Mã đề 002 (Kèm đáp án)
Bạn đang xem tài liệu "Đề thi thử môn Hóa học - Kỳ thi thử THPT Quốc gia lần 2 - Năm học 2018-2019 - Trường THPT Nguyễn Trung Thiên - Mã đề 002 (Kèm đáp án)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề thi thử môn Hóa học - Kỳ thi thử THPT Quốc gia lần 2 - Năm học 2018-2019 - Trường THPT Nguyễn Trung Thiên - Mã đề 002 (Kèm đáp án)
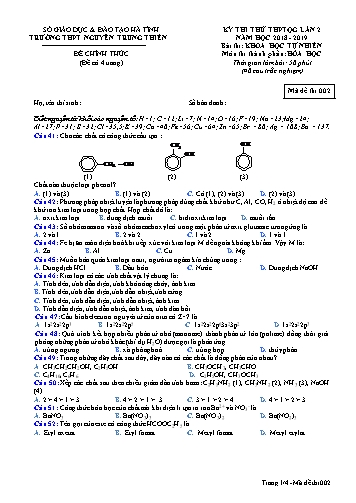
SỞ GIÁO DỤC & ĐÀO TẠO HÀ TĨNH KỲ THI THỬ THPTQG LẦN 2 TRƯỜNG THPT NGUYỄN TRUNG THIÊN NĂM HỌC 2018 - 2019 Bài thi: KHOA HỌC TỰ NHIÊN ĐỀ CHÍNH THỨC Môn thi thành phần: HÓA HỌC (Đề có 4 trang) Thời gian làm bài: 50 phút (40 câu trắc nghiệm) Mã đề thi 002 Họ, tên thí sinh:............................................................Số báo danh: ............................. Biết nguyên tử khối các nguyên tố: H=1; C=12; Li=7; N=14; O=16; F=19; Na=23; Mg=24; Al=27; P=31; S=32; Cl=35,5; K=39; Ca=40; Fe=56; Cu=64; Zn=65; Br = 80; Ag = 108; Ba = 137. Câu 41: Cho các chất có công thức cấu tạo : OH CH3 OH CH2 OH (1) (2) (3) Chất nào thuộc loại phenol? A. (1) và (3). B. (1) và (2). C. Cả (1), (2) và (3). D. (2) và (3). Câu 42: Phương pháp nhiệt luyện là phương pháp dùng chất khử như C, Al, CO, H2 ở nhiệt độ cao để khử ion kim loại trong hợp chất. Hợp chất đó là: A. oxit kim loại. B. dung dịch muối. C. hidroxit kim loại. D. muối rắn. Câu 43: Số nhóm amino và số nhóm cacboxyl có trong một phân tử axit glutamic tương ứng là A. 2 và l. B. 2 và 2. C. l và 2. D. 1 và 1. Câu 44: Fe bị ăn mòn điện hoá khi tiếp xúc với kim loại M để ngoài không khí ẩm. Vậy M là: A. Zn B. Al C. Cu D. Mg Câu 45: Muốn bảo quản kim loại natri, người ta ngâm kín chúng trong : A. Dung dịch HCl B. Dầu hỏa C. Nước D. Dung dịch NaOH Câu 46: Kim loại có các tính chất vật lý chung là: A. Tính dẻo, tính dẫn điện, tính khó nóng chảy, ánh kim. B. Tính dẻo, tính dẫn điện, tính dẫn nhiệt, tính cứng. C. Tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim. D. Tính dẫn điện, tính dẫn nhiệt, ánh kim, tính đàn hồi. Câu 47: Cấu hình electron nguyên tử của nitơ có Z=7 là A. 1s22s22p1. B. 1s22s22p5. C. 1s22s22p63s23p2. D. 1s22s22p3. Câu 48: Quá trình kết hợp nhiều phân tử nhỏ (monome) thành phân tử lớn (polime) đồng thời giải phóng những phân tử nhỏ khác (thí dụ H2O) được gọi là phản ứng A. trùng ngưng. B. xà phòng hoá. C. trùng hợp. D. thủy phân. Câu 49: Trong những dãy chất sau đây, dãy nào có các chất là đồng phân của nhau ? A. CH3CH2CH2OH, C2H5OH. B. CH3OCH3, CH3CHO. C. C4H10, C6H6. D. C2H5OH, CH3OCH3. Câu 50: Xếp các chất sau theo chiều giảm dần tính bazơ: C 2H5NH2 (1), CH3NH2 (2), NH3 (3), NaOH (4). A. 2 > 4 > 1 > 3B. 4 > 2 > 1 > 3 C. 3 > 1 > 2 > 4 D. 4 > 1 > 2 > 3 2+ - Câu 51: Công thức hóa học của chất mà khi điện li tạo ra ion Ba và NO3 là A. BaNO3.B. Ba(NO 3)3.C. Ba(NO 3)2.D. Ba(NO 2)3. Câu 52: Tên gọi của este có công thức HCOOC2H5 là A. Etyl axetatB. Etyl fomat C. Metyl fomatD. Metyl etylat Trang 1/4 - Mã đề thi 002 Câu 63: Một este có công thức phân tử C 4H6O2. Thuỷ phân hết 1mol X thành hỗn hợp Y. X có công thức cấu tạo nào để Y cho phản ứng tráng gương tạo ra lượng Ag lớn nhất? A. HCOOCH = CHCH3. B. HCOOCH2CH = CH2. C. CH3COOCH = CH2. D. CH2 = CHCOOCH3. Câu 64: Ở điều kiện thích hợp, 2 chất nào sau đây phản ứng với nhau tạo thành metylaxetat A. CH3COOH và CH3OH. B. CH3COOH và C2H5OH. C. HCOOH và CH3OH. D. HCOOH và C2H5OH. Câu 65: Số liên kết peptit có trong một phân tử Ala-Gly-Val-Gly-Ala là A. 5. B. 2. C. 4. D. 3. Câu 66: Thực hiện các thí nghiệm sau ở điều kiện thường: (a) Sục khí H2S vào dung dịch Pb(NO3)2. (b) Cho CaO vào H2O. (c) Cho Na2CO3 vào dung dịch CH3COOH. (d) Sục khí Cl2 vào dung dịch Ca(OH)2. (e) Cho Si vào dung dịch NaOH. (g) Cho Na2SO3 vào dung dịch H2SO4. Số thí nghiệm xảy ra phản ứng là: A. 5 B. 3 C. 4 D. 6 Câu 67: Đốt cháy hoàn toàn 3,7 g hỗn hợp 2 ankan X,Y là đồng đẳng kế tiếp sau phản ứng thu được 5,6 lít CO2 (đktc). X,Y có công thức phân tử là : A. CH4 và C4H10 B. C2H6 và C3H8 C. C3H8 và C4H10 D. CH4 và C2H6 Câu 68: Đốt cháy hoàn toàn 0,25 mol một este B thì thu được 33g CO2 và 13,5g H2O. CTPT của B là: A. C2H4O2 B. C4H8O2 C. C3H4O2 D. C3H6O2 Câu 69: Hòa tan m gam kim loại Na vào nước được dung dịch A và có 10,08 lít H 2 bay ra (đkc). Cần dùng bao nhiêu ml dung dịch HCl 2M để trung hòa 1/10 dung dịch A (ml) A. 450 B. 45 C. 900 D. 90 Câu 70: Đốt cháy hoàn toàn 0,12 mol chất hữu cơ X mạch hở cần dùng 10,08 lít khí O 2 (đktc). Dẫn toàn bộ sản phẩm cháy gồm CO 2, H2O và N2 qua bình đựng dung dịch Ba(OH) 2 dư, thấy khối lượng bình tăng 23,4 gam và có 70,92 gam kết tủa. Khí thoát ra khỏi bình có thể tích 1,344 lít (đktc). Công thức phân tử của X là A. C2H5O2N. B. C3H5O2N. C. C3H7O2N. D. C2H7O2N. Câu 71: Cho 21,6g một kim loại chưa biết hoá trị tác dụng hết với dung dịch HNO 3 thu được 6,72 lít N2O (đktc). Kim loại đó là A. Zn B. Al C. Na D. Mg Câu 72: Hoà tan hoàn toàn 8,862 gam hỗn hợp gồm Al và Mg vào dung dịch HNO 3 loãng, thu được dung dịch X và 3,136 lít (ở đktc) hỗn hợp Y gồm hai khí không màu, trong đó có một khí hoá nâu trong không khí. Khối lượng của Y là 5,18 gam. Cho dung dịch NaOH (dư) vào X và đun nóng, không có khí mùi khai thoát ra. Phần trăm khối lượng của Al trong hỗn hợp ban đầu là A. 15,25% B. 12,80% C. 10,52% D. 19,53% Câu 73: Hoà tan 2,4 gam một oxit sắt cần vừa đủ 90 ml dung dịch HCl 1M. Công thức của oxit sắt nói trên là: A. Fe2O3. B. Fe3O4. C. FeO D. Fe2O3 hoặc Fe3O4 Câu 74: Xenlulozo trinitrat được điều chế từ xenlulozo và axit nitric đặc có xúc tác là axit sunfuric đặc, nóng. Để có 14,85 kg xenlulozo trinitrat, cần dùng dung dịch chứa m kg axit nitric (Biết hiệu suất của quá trình là 90%). Giá trị của m là: A. 10,5. B. 9,45. C. 8,505. D. 9 Trang 3/4 - Mã đề thi 002
File đính kèm:
 de_thi_thu_mon_hoa_hoc_ky_thi_thu_thpt_quoc_gia_lan_2_nam_ho.doc
de_thi_thu_mon_hoa_hoc_ky_thi_thu_thpt_quoc_gia_lan_2_nam_ho.doc đáp án chính thức.xlsx
đáp án chính thức.xlsx